
Come già espresso (Locatelli, et al., 2024), le modificazioni quantitative e qualitative età-correlate del tessuto muscolare e il declino della forza muscolare costituiscono due aspetti fondamentali di una tipica sindrome geriatrica definita sarcopenia. La rilevanza di tale condizione non è da attribuirsi solo all’elevata prevalenza, legata all’invecchiamento globale della popolazione, ma anche alle sue importanti implicazioni su disabilità, qualità di vita e mortalità. In tutti i soggetti con 65 anni e più viene quindi raccomandato uno screening per la ricerca di sarcopenia, da effettuare in modo sistematico e con cadenza almeno annuale: già la diagnosi di sarcopenia probabile, per riscontro di riduzione della forza muscolare, consente l’avvio di interventi terapeutici.
Screening e diagnosi di sarcopenia
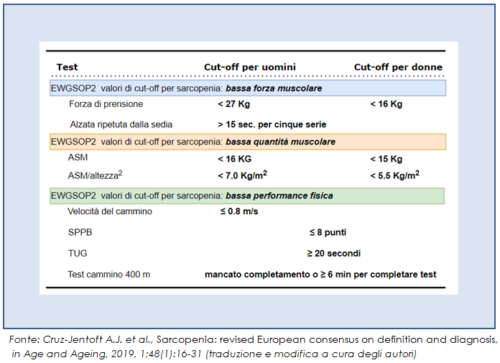
L’indagine si esegue con strumenti di facile e veloce applicazione, come il test della velocità del cammino e il questionario SARC-F. Il test del cammino (walking speed) è la metodica più frequentemente utilizzata nella pratica clinica per misurare la performance fisica. Il soggetto è invitato a camminare con passo normale e il valutatore rileva il tempo impiegato a percorrere 4 o 6 metri: una velocità inferiore a 0.8 metri al secondo è considerata indicativa di bassa performance fisica. Il questionario SARC-F è composto da 5 item, con punteggi fra 0 e 2 per ogni domanda (figura 1); un punteggio totale pari o maggiore di 4 è indicativo di bassa forza muscolare.

Il riscontro di bassa performance fisica e di bassa forza muscolare tramite questi due strumenti supporta la necessità di confermare la condizione di sarcopenia con ulteriori approfondimenti. Per confermare la diagnosi, è raccomandato l’utilizzo di misure e strumenti di valutazione che forniscano valori oggettivi, sia sulla forza muscolare che sulla performance fisica.
La definizione europea di sarcopenia attualmente in uso (EWGSOP2) indica i criteri diagnostici imprescindibili per definire questa sindrome:
- riduzione della forza muscolare = sarcopenia probabile;
- riduzione della forza muscolare + riduzione di quantità e qualità della massa muscolare = sarcopenia certa;
- riduzione della forza muscolare + riduzione di quantità e qualità della massa muscolare + riduzione della performance fisica = sarcopenia severa (Cruz-Jentoft, et al., 2019).
Un test di facile e rapida esecuzione per valutare la forza muscolare è l’Handgrip Strength test, che misura la forza massima di prensione esercitata dai muscoli dell’avambraccio. Quando l’Handgrip Strength test non è effettuabile (per disabilità o limitazione funzionale dell’arto superiore) è utilizzabile il Chair Stand test, che fornisce una misura indiretta della forza muscolare valutando il tempo impiegato per completare cinque volte il passaggio dalla posizione seduta a quella eretta, senza l’uso degli arti superiori.
Il riscontro di una ridotta forza muscolare in queste prove supporta la necessità di valutare la presenza di ridotta quantità o qualità muscolare, che potrebbe così confermare la diagnosi di sarcopenia. Secondo le linee guida europee per la misurazione della massa muscolare, il gold standard è rappresentato dalla Risonanza Magnetica (MRI) o, in alternativa, dalla Tomografia Computerizzata, in particolar modo la Peripheral Quantitative Tomography (pqCT). Si tratta di tecniche molto accurate, che consentono di misurare la massa muscolare a livello di una sezione corporea, valutando anche la qualità del muscolo e la presenza di eventuali infiltrati di tessuto adiposo. Purtroppo necessitano di attrezzature molto ingombranti e non sempre disponibili, specie in contesti non ospedalieri; hanno inoltre costi elevati e, nel caso della pqCT, un’alta esposizione a raggi X.
Per superare i limiti di MRI e pqCT sono stati identificati altri strumenti diagnostici: tra questi, la Densitometria assiale a raggi X (DEXA) permette di misurare massa magra, massa grassa e osso sia a livello di singoli distretti corporei, sia in total-body. La DEXA determina per il paziente una minore esposizione ai raggi X, ma richiede un’attrezzatura ingombrante; in alternativa, la Bioimpedenziometria (BIA) – che consente di ricavare una misurazione indiretta della massa muscolare – è uno strumento trasportabile e ha costi poco elevati.
Negli ultimi anni sta acquisendo sempre più importanza l’ecografia muscolare. Si tratta di una tecnica semplice, di rapida esecuzione e non invasiva, che sfrutta uno strumento portatile ed economico e consente di valutare più distretti corporei. Tuttavia, tale metodica non offre una stima total-body sulla qualità e quantità muscolare e necessita un training adeguato e continuativo per l’operatore, per ottenere un esame il più possibile affidabile.
Infine, misurazioni indirette di massa muscolare sono rappresentate dai parametri antropometrici, come circonferenza del polpaccio e circonferenza del braccio. Queste misurazioni permettono di valutare differenti distretti corporei e sono semplici, di facile esecuzione e di basso costo. Sono misure la cui affidabilità è però influenzata da variabili legate allo stato nutrizionale del soggetto o a patologie acute e/o croniche (es. scompenso cardiaco). Tuttavia, alla luce del loro largo uso nella pratica clinica, negli ultimi anni sono state elaborate diverse equazioni che – considerando variabili come età, sesso ed etnia – permettono di ricavare una stima abbastanza affidabile della massa muscolare totale o appendicolare a partire da dati antropometrici.
Se, a conclusione di queste indagini, si evidenzia sia una ridotta forza muscolare che una ridotta quantità e qualità muscolare (sarcopenia confermata), l’argoritmo diagnostico impone di valutare anche la performance fisica del paziente, per stabilire il grado di severità della sarcopenia. Per valutare la performance fisica del soggetto si utilizzano:
- test del cammino che, come già accennato, misura il tempo impiegato per percorrere la distanza di 4 o 6 metri a velocità normale;
- Timed Up and Go (TUG) test, in cui si valuta il tempo necessario al paziente per alzarsi da una sedia, camminare per 3 metri, girarsi, tornare indietro e risedersi;
- Short Physical Performance Battery (SPPB), che include test della marcia, valutazione dell’equilibrio e Chair Stand test; questa batteria di test viene utilizzata più a scopo di ricerca, che nella pratica clinica;
- test del cammino su 400 metri, che valuta il tempo richiesto per percorrere 400 metri e funge da indicatore di performance fisica e di resistenza.
Sarcopenia e nutrizione: l’intake proteico ottimale nell’anziano
Le linee guida ESPEN prevedono come introito ottimale giornaliero per un soggetto anziano circa 30 kcal per kg di peso corporeo; l’apporto proteico giornaliero dovrebbe essere pari ad almeno 1 g per kg di peso corporeo. L’introito calorico e l’introito proteico dovrebbero poi essere modulati in base allo stato nutrizionale di partenza, al livello di attività fisica e alla condizione clinica del paziente. Per quanto riguarda l’apporto di liquidi, le linee guida suggeriscono come rapporto ottimale 1.6 l di liquidi/die (Volkert, et al., 2022).
I Livelli di Assunzione di Riferimento di Nutrienti ed energia (LARN) per la popolazione italiana raccomandano almeno 1.1 g di proteine per kg di peso corporeo al giorno per gli over 60; con questo apporto giornaliero viene mantenuto sia un buono stato nutrizionale, che una buona massa muscolare (SINU, 2014).
Già uno studio pubblicato nel 2013 aveva evidenziato che l’apporto proteico giornaliero di 1 g per kg di peso corporeo potrebbe essere troppo basso per il paziente anziano, consigliando di aumentarlo a 1.2 g (Bauer, et al., 2013). Grande novità di questo studio è l’indicazione dell’apporto adeguato di proteine per pasto: è stato infatti introdotto per la prima volta il concetto di ridistribuzione proteica nell’arco delle 24 ore, riferendosi alla quantità e qualità di proteine che dovrebbero essere assunte per ogni pasto.
Nello specifico, i ricercatori hanno individuato come valore ottimale di distribuzione proteica, per il paziente anziano, 25-30 g di proteine per pasto e almeno 2.5-2.8 g di leucina, al fine di promuovere i processi anabolici che favoriscono la sintesi di nuove proteine per riparare e ricostruire nuove fibre muscolari. Nella popolazione anziana, tuttavia, la ridistribuzione proteica non risulta spesso soddisfatta per diversi fattori; l’anziano tende ad avere un inadeguato consumo proteico, spesso sbilanciato tra i pasti della giornata.
Le proteine, elementi fondamentali per la massa muscolare
Non esiste una fonte proteica migliore di un’altra: tutte le tipologie di proteine vanno consumate ed è importante includere nella propria dieta tutti gli amminoacidi, perché hanno un ruolo importante nella ricostruzione muscolare. Gli amminoacidi essenziali che hanno ruoli maggiormente importanti per la costruzione del muscolo sono:
- leucina, base fondamentale per l’avvio della ricostruzione del muscolo; una sua supplementazione, anche nell’anziano sarcopenico, può rallentare la perdita di massa muscolare;
- arginina: stimola la sintesi di collagene ed è direttamente coinvolta nei processi biologici che sostengono l’efficienza dell’immunità cellulo-mediata; stress e infiammazione ne inficiano la sintesi;
- glutammina: favorisce il metabolismo muscolare nel corso di infezioni, traumi, infiammazioni;
- beta-idrossi-beta-metilbutirrato (HMB): metabolita della leucina, interviene nella ricostruzione della massa muscolare e aiuta a supportare forza e funzionalità del muscolo.
Alcuni studi hanno confrontato colazioni a base di proteine animali e colazioni a base di proteine vegetali, di pari apporto proteico. La colazione a base di proteine animali è risultata con un bilancio proteico netto migliore rispetto a quella a base di proteine vegetali. Riguardo il latte e i suoi derivati, si è osservato che nelle donne anziane che consumano ogni giorno alimenti a base di proteine del latte vi è una ridotta incidenza di sarcopenia.
Riguardo le proteine vegetali (cereali, legumi), sono opportune alcune considerazioni aggiuntive: i cereali hanno come amminoacido limitante la lisina, i legumi hanno invece livelli inferiori di amminoacidi solforati (es. metionina, cisteina). Le proteine vegetali hanno inoltre un elevato apporto di fibre, vitamine e antiossidanti; il loro consumo è stato associato a una minore incidenza di diabete mellito di tipo 2, malattie cardiovascolari, alcune neoplasie (es. cancro del colon retto, tumore della prostata, tumore del pancreas e dello stomaco).
Oltre alle proteine: le vitamine e gli antiossidanti
La letteratura riporta come livelli ridotti di vitamina D nella dieta siano correlati a una riduzione della massa muscolare e quindi a una maggiore incidenza di sarcopenia. Diverse pubblicazioni documentano il ruolo chiave della vitamina D non solo nella prevenzione, ma anche nella cura della sarcopenia: essa infatti sostiene, insieme agli amminoacidi, la biosintesi muscolare. È assodato che un maggior consumo settimanale di pesce – alimento che apporta proteine, vitamina D e vitamina E – è direttamente associato a una minore incidenza di sarcopenia. Tra le vitamine contenute nella frutta, la A e la C sono attualmente oggetto di studio per la prevenzione e la cura della sarcopenia; in particolare, si è visto che il beta-carotene (precursore della vitamina A) è associato a una migliore performance fisica.
Tra gli antiossidanti, la bromelina e la curcumina sembrano le molecole più promettenti: la bromelina parrebbe prevenire l’indebolimento fisico e avere un effetto miorilassante; la curcumina sembra avere effetti anti-infiammatori a livello muscolare, migliorando la prestazione muscolare. Sono necessari ulteriori studi, per poter definire dosi e raccomandazioni giornaliere di assunzione.
Interventi dietoterapici nei pazienti con sarcopenia
Un gruppo di studio dell’Università di Padova ha proposto un intervento dietetico ambulatoriale in pazienti over 65 anni, per ridurre il rischio cardiovascolare e prevenire la sarcopenia. Lo studio ha suddiviso in due gruppi la popolazione studiata, somministrando una dieta mediterranea al primo gruppo e una dieta con ridistribuzione proteica al secondo gruppo. I risultati hanno messo in evidenza come una dieta con ridistribuzione proteica possa contribuire in maniera positiva al calo di peso corporeo (sia in termini di BMI che di circonferenza addominale), mantenendo e in alcuni casi migliorando gli indici di massa muscolare e riducendo il rischio cardiovascolare (Toniazzo, et al., 2022).
Riguardo all’anziano ospedalizzato, sarcopenia, fragilità e disfagia sono condizioni che mostrano forti interconnessioni. Nell’anziano ricoverato che presenta disfagia vi è un altissimo rischio di malnutrizione, caratterizzato da una riduzione dell’introito alimentare. Se il paziente presenta anche sarcopenia, si può arrivare a una facile esauribilità muscolare, con astenia e affaticabilità che aumentano il rischio di caduta e di frattura. La cascata patologica che ne deriva può portare a eventi potenzialmente fatali per il paziente.
In campo dietetico si ha quindi l’estrema necessità di supportare questi pazienti. In generale, il paziente anziano ospedalizzato non si alimenta a sufficienza; si stima che il 35-38% del cibo somministrato venga, per vari motivi, non consumato. L’introito reale apportato in un anziano ricoverato è stimato fra 1.100 e 1.600 kcal, con un apporto proteico fra 47 e 67 g. Più della metà dei pazienti anziani ricoverati ha un introito di cibo inferiore al 90% delle aspettative; in tre quarti dei casi si ha un introito proteico inferiore del 90% rispetto a quello consigliato dalle linee guida. Diversi aspetti possono incidere su tale problematica, per esempio:
- difficoltà nella percezione di sapori e profumi (per le modifiche che avvengono in età anziana ai sensi di gusto e olfatto);
- difficoltà legate alla struttura del cibo (consistenza troppo dura o troppo liquida);
- difficoltà nel conciliare gli orari dei pasti assunti a domicilio con quelli ospedalieri;
- solitudine e assenza di una persona di fiducia che assista l’anziano nell’assunzione dei pasti.
Risulta quindi necessario migliorare la tecnica di supporto nutrizionale, per cercare di limitare l’impatto del ricovero ospedaliero almeno dal punto di vista dell’alimentazione. Al momento dell’ingresso in reparto, il paziente anziano dovrebbe essere sottoposto a uno screening, per valutare il rischio di malnutrizione. Un intervento dietoterapico precoce e l’elaborazione di una dieta personalizzata è di estrema importanza: può migliorare alcuni esiti dell’ospedalizzazione.
Purtroppo, anche seguire la dieta personalizzata non si rivela sempre di facile esecuzione: il paziente può risultare difficile da accontentare e poco incline ad accettare alimenti proteici, in termini sia di gusto che di digeribilità; si deve dunque ricorrere a supplementi per via orale, tramite integratori la cui scelta spetta al professionista esperto in dietoterapia; un aspetto importante consiste nel cambiare gusto dell’integratore, per cercare di aumentare la compliance alla dietoterapia.
Secondo le linee guida OMS, l’integratore ideale deve essere costituito da circa 400 kcal/die e 30 g o più di proteine/die; deve inoltre garantire un adeguato apporto di vitamina D e di calcio. In linea generale, se un paziente ha un deficit nutritivo sia calorico che proteico, ci si orienta verso supplementi calorici e proteici; se invece un paziente consuma adeguatamente gli apporti calorici nei pasti, va valutato se il bilancio proteico per quel paziente è adeguato e, a seconda del caso, si può intervenire con supplementi esclusivamente proteici o amminoacidici oppure con supplementi che favoriscono e stimolano la sintesi proteica. In commercio esistono infatti integratori non calorici, ma che apportano solo amminoacidi essenziali.
Seguendo la teoria della ridistribuzione proteica, il supplemento dovrebbe andare a integrare tutti i pasti, per raggiungere i 25-30 g di proteine per pasto suggeriti dalla letteratura. Sarebbe auspicabile, inoltre, mettere in atto una serie di strategie per ottimizzare sia la compliance, che la supplementazione necessaria al paziente. Ad esempio, si potrebbe utilizzare il gusto neutro, frazionare l’assunzione dei supplementi, oppure discioglierli direttamente nelle pietanze. Si potrebbero inoltre utilizzare alimenti naturali addizionati, come ad esempio spremute arricchite da proteine (sieroproteine o maltodestrine), ottenendo delle merende fortificate dall’ottimo valore calorico e proteico (tabella 2). Dopo le dimissioni, è importante che il paziente segua la dietoterapia anche nel setting di destinazione.

Infine, in termini di prevenzione l’Harvard Medical School ha pubblicato il piatto del mangiar sano (figura 2). Questo può essere applicato in versione modificata e in maniera specifica per la sarcopenia, raccomandando la ridistribuzione proteica nei tre pasti principali della giornata, un buon apporto idrico giornaliero, l’olio extra-vergine di oliva come unica fonte di condimento, frutta e verdura a ogni pasto. Una raccomandazione importante deve essere poi data sulla vitamina D, al fine di mantenerne adeguati livelli plasmatici, anche tramite l’esposizione solare giornaliera. Se possibile, tutto ciò deve essere associato a un’adeguata attività fisica.

Approccio fisioterapico nella sarcopenia
Come sopra riportato, l’esercizio fisico costante e il mantenimento di una vita attiva sono fattori protettivi contro lo sviluppo di sarcopenia e, più in generale, contro il deterioramento dello stato di salute dell’anziano. Viceversa, gli eventi che possono accelerare drasticamente il declino muscolare dell’individuo prendono il nome di crisi cataboliche; comprendono ospedalizzazione, patologie acute e periodi di allettamento.
L’intervento che ad oggi ha dimostrato maggiori evidenze scientifiche insieme alla dietoterapia è l’esercizio fisico, in particolare l’esercizio fisico di rinforzo muscolare (resistance exercise/ resistance training). Gli esperti sono concordi sulla sua efficacia nel rallentare la sarcopenia, anche nel paziente allettato: favorisce e aumenta la forza e la massa muscolare, previene la riduzione selettiva delle fibre muscolari di tipo II, aumenta la sintesi delle proteine muscolari e ne riduce al contempo il catabolismo. All’interno di ogni setting dovrebbero quindi essere previsti percorsi riabilitativi personalizzati, mirati a evitare la sindrome d’allettamento e la sarcopenia.
In generale, l’American College of Sports Medicine (Nelson, et al., 2007) e la World Health Organization (WHO, 2018) raccomandano per tutte le persone anziane:
- almeno 150 minuti a settimana di attività fisica aerobica a intensità moderata;
- in alternativa, 75 minuti di attività fisica aerobica ad alta intensità;
- 2-3 interventi settimanali di esercizio fisico contro resistenza oppure di training misto (esercizio contro resistenza associato a esercizio fisico aerobico), con una durata complessiva di 60-70 minuti (pause di riposo incluse).
Esercizio fisico nella sarcopenia
Nel 2018 un comitato internazionale di esperti ha redatto le linee guida cliniche relative agli interventi terapeutici per i pazienti con sarcopenia, in cui è stata inserita una forte raccomandazione rispetto all’attività fisica. Il soggetto con sarcopenia o a rischio di sviluppare sarcopenia dovrebbe svolgere esercizio fisico personalizzato associato all’utilizzo di integratori specifici, al fine di migliorare la forza muscolare, mantenere la massa muscolare e migliorare così la performance fisica. A questo proposito si è notato infatti come l’intervento congiunto di esercizio fisico, inteso come esercizi contro resistenza, e supplementazione con appropriati integratori sia molto più efficace che applicare uno solo dei due interventi (Dent, et al., 2018).
L’esercizio fisico contro resistenza può essere effettuato con diverse modalità:
- tramite l’utilizzo di macchinari (Machine-Based Training): è una modalità che permette di controllare molto accuratamente il livello di intensità dell’esercizio fisico e di garantire la sicurezza del paziente durante la sessione di allenamento; tuttavia, questi macchinari risultano spesso costosi e difficilmente accessibili per la popolazione anziana generale;
- tramite l’utilizzo di elastici (Elastic-Based Training): è una modalità poco costosa e facilmente accessibile; tuttavia, la tipologia di esercizi non consente un buon controllo del livello d’intensità dell’esercizio stesso;
- sfruttando la contrazione eccentrica (Eccentric-Based Training): questa modalità può essere svolta sia tramite l’utilizzo di macchinari iso-cinetici o iso-potenziali, sia a corpo libero (come ad esempio salire o scendere le scale).
Di notevole importanza risulta anche l’intensità con cui il singolo paziente svolge l’esercizio fisico. A questo riguardo, esistono due principali sistemi di valutazione:
- One-Repetition Maximum (1RM): rappresenta il massimo peso (espresso in kg) sollevabile per singola volta. È considerato un gold standard estremamente affidabile per valutare l’intensità dell’esercizio; richiede però molto tempo per essere eseguito in maniera accurata, deve essere preceduto da una fase di addestramento, non è esente da rischi di infortunio muscolo-scheletrici;
- One-Repetition Maximum indiretto (1RM-indiretto): permette di utilizzare carichi inferiori al massimale sollevabile e, considerando il numero di ripetizioni svolte dal soggetto, consente di calcolare l’1RM, tramite opportune tabelle di conversione.
Dati derivanti da revisioni sistematiche della letteratura indicano che, per prevenire o trattare la sarcopenia, la persona anziana dovrebbe eseguire esercizi contro resistenza a un’intensità pari o superiore al 50% (intensità moderata-elevata) alla 1RM del gruppo muscolare che si intende allenare, con un volume di allenamento fra 7 e 9 ripetizioni per serie (Ferreira, et al., 2023).
Lo SPRINT-T PROJECT
Lo SPRINT-T project è un trial multicentrico randomizzato controllato, finanziato con fondi europei e coordinato dall’Unità di Geriatria del Policlinico Gemelli di Roma – Università Cattolica del Sacro Cuore. Sviluppato fra il 2016 e il 2019, il progetto ha coinvolto 16 centri in tutta Europa e ha permesso di accrescere le conoscenze nel campo degli interventi efficaci per contrastare la sarcopenia, concentrandosi sul ruolo di esercizio fisico e dietoterapia. Lo studio ha coinvolto soggetti di età pari o superiore ai 70 anni, di entrambi i sessi, con fragilità fisica e sarcopenia, ma senza disabilità nella mobilità. Sono state valutate oltre 12.000 persone, di cui 1.519 hanno risposto ai criteri di inclusione.
L’obiettivo primario dello studio era valutare l’effetto dell’intervento nel prevenire la comparsa di disabilità nella mobilità, misurata mediante il test del cammino sui 400 metri. Obiettivi secondari hanno considerato le variazioni di performance fisica (attraverso l’SPPB) e forza muscolare (attraverso l’Handgrip Strength test). Il campione è stato randomizzato in due gruppi: gruppo di intervento – che svolgeva regolare esercizio fisico, controllo del livello di attività fisica e dietoterapia – e gruppo di controllo, dove venivano proposti solo interventi di tipo educativo. È stata effettuata un’analisi intention-to-treat, sottoponendo i pazienti arruolati a follow-up periodici: i pazienti sono stati valutati per la prima volta a 3 mesi dall’inizio dello studio e successivamente a periodi regolari di 6 mesi, fino all’ultima valutazione effettuata al 36esimo mese.
Lo studio ha dimostrato che un intervento multidisciplinare basato sull’attività fisica e sulla dietoterapia è associato a una riduzione di disabilità nella mobilità in soggetti anziani con fragilità fisica e sarcopenia. Nonostante gli ottimi risultati dello studio va però riconosciuto che, rispetto ad altri outcome quali ospedalizzazioni, rischio di cadute, fratture e sviluppo di patologie acute, non si sono rilevate differenze statisticamente significative tra i due gruppi in studio.
Riflessioni conclusive
Il progressivo invecchiamento della popolazione e l’aumento delle diagnosi di sarcopenia hanno influito sul crescente interesse della comunità scientifica per questa sindrome; la sarcopenia nel soggetto anziano, infatti, è strettamente connessa al declino funzionale e alla disabilità. I fattori cardine coinvolti in questa entità clinica sono molteplici e includono l’età del paziente, le malattie croniche concomitanti, il grado di deficit nutrizionale, lo stile di vita sedentario e l’allettamento prolungato: questi fattori dovrebbero essere presi in considerazione per una diagnosi tempestiva e per un trattamento personalizzato, al fine di conseguire un esito terapeutico di successo e di raggiungere una migliore qualità della vita.
Anche se negli ultimi anni sono stati compiuti progressi significativi, per essere efficace e completo il trattamento della sarcopenia richiede ancora una grande attenzione e un approccio interdisciplinare, costituito da una combinazione di esercizi specifici e programmati, da una dieta adeguata, dall’inserimento di integratori alimentari e in alcuni casi di agenti farmaceutici.
Bibliografia
Bauer J., Biolo G., Cederholm T., Cesari M., Cruz-Jentoft A.J., Morley J.E., Stuart P., Sieber C., Stehle P., Daniel T., Visvanathan R., Volpi E., Boirie Y. (2013), Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group, in Journal of the American Medical Directors Association, 14(8):542-559.
Cruz-Jentoft A.J., Bahat G., Bauer J., Boirie Y., Bruyère O., Cederholm T., Cooper C., Landi F., Rolland Y., Sayer A.A., Schneider S.M., Sieber C.C., Topinkova E., Vandewoude M., Visser M., Zamboni M. (2019), Sarcopenia: revised European consensus on definition and diagnosis, in Age and Ageing, 1;48(1):16-31.
Dent E., Morley J.E., Cruz-Jentoft A.J., Arai H., Kritchevsky S.B., Guralnik J., Bauer J.M., Pahor M., Clark B.C., Cesari M., Ruiz J., Sieber C.C., Aubertin-Leheudre M., Waters D.L., Visvanathan R., Landi F., Villareal D.T., Fielding R., Won C.W., Theou O., Martin F.C., Dong B., Woo J., Flicker L., Ferrucci L., Merchant R.A., Cao L., Cederholm T., Ribeiro S.M.L., Rodríguez-Mañas L., Anker S.D., Lundy J., Gutiérrez Robledo L.M., Bautmans I., Aprahamian I., Schols J.M.G.A., Izquierdo M., Vellas B. (2018), International Clinical Practice Guidelines for Sarcopenia (ICFSR): screening, diagnosis and management, in The Journal of Nutrition, Health and Aging, 22(10):1148-1161.
Ferreira L.F., Lopes Scariot E., Telles da Rosa L.H. (2023), The effect of different exercise programs on sarcopenia criteria in older people. A systematic review of systematic reviews with meta-analysis, in Archives of Gerontology and Geriatrics,105:104868.
Locatelli E., Volpato S., Trevisan C. (2024), Interdisciplinarietà nella persona anziana con sarcopenia. Inquadramento e impatto della sarcopenia nell’anziano, in I luoghi della cura, n. 1.
Nelson M.E., Rejeski W.J., Blair S.N., Duncan P.W., Judge J.O., King A.C., Macera C.A., Castaneda-Sceppa C. (2007), Physical activity and public health in older adults: recommendation from the American College of Sports Medicine and the American Heart Association, in Medicine & Science in Sports & Exercise, 39(8):1435-1445.
SINU Società Italiana di Nutrizione Umana (2014), Livelli di assunzione di riferimento di nutrienti ed energia (LARN) per la popolazione italiana. IV revisione, SICS Editore.
Toniazzo S., Ceolin C., Tognana G., Cazzola M., Boscolo M.M., Zorzin C., Spinella P., Sergi G. (2022), Intervento dietetico su setting ambulatoriale per ridurre il rischio cardiovascolare e prevenire la sarcopenia negli anziani: dati preliminari, poster al 3° Congresso Nazionale Accademia di Geriatria, Pisa.
Volkert D., Beck A.M., Cederholm T., Cruz-Jentoft A., Hooper L., Kiesswetter E., Maggio M., Raynaud-Simon A., Sieber C., Sobotka L., van Asselt D., Wirth R., Bischoff S.C. (2022), ESPEN practical guideline: clinical nutrition and hydration in geriatrics, in Clinical Nutrition, 41(4): 958-989.
WHO World Health Organization (2018), Global action plan on physical activity 2018-2030. More active people for a healthier world, World Health Organization.












